百致生物医药科技(上海)有限公司
9 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 1.2000000000000002
- 0.20000000000000018
公司新闻/正文
研究思路|脓毒症期间乳酸对巨噬细胞中 HMGB1 的乳酸化修饰
15811 人阅读发布时间:2022-07-27 17:39
乳酸 ( Lactate ) 是细胞糖酵解途径重要的含碳代谢产物,在肿瘤细胞中 Warburg 效应中具有重要作用。乳酸化修饰 ( lactylation,Kla ) 是 2019 年芝加哥大学赵英明教授课题组在 Nature 杂志报道的全新蛋白质翻译后修饰类型 [1]。
在「writer」组蛋白乙酰基转移酶 p300 作用下,使组蛋白发生乳酸化修饰 (Kla),调控免疫激活过程中巨噬细胞极化相关基因表达 [2]。
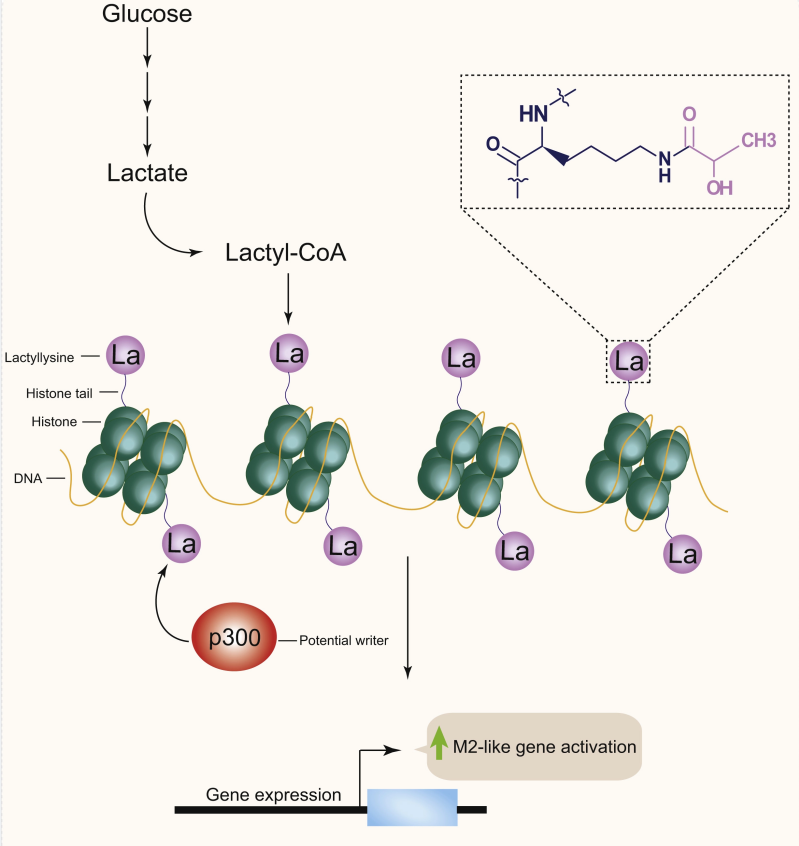
后续研究进一步证实,蛋白质乳酸化修饰是乳酸发挥功能的重要方式,参与糖酵解相关细胞功能、神经系统调控、巨噬细胞极化等重要过程 [3,4]。
下面我们以东田纳西州立大学李传富(Chuanfu li)团队于 2021 年 8 月在 Cell Death & Differentiation 发表题为 "Lactate promotes macrophage HMGB1 lactylation, acetylation,and exosomal release in polymicrobial sepsis" 的研究论文为参考文献 [5],对乳酸化修饰的研究手段进行讨论。
一、简介
脓毒症是一种对感染反应失调导致的器官功能障碍综合症,血清乳酸被认为是脓毒症预后的生物标志物,血清乳酸水平升高与脓毒症死亡率呈正相关。HMGB1 是一种普遍存在的核蛋白,可由活化的巨噬细胞释放,以协调炎症反应。临床证据表明,循环 HMGB1 水平显著升高,并与脓毒症的严重程度和死亡率呈正相关。本研究探讨了乳酸是否能促进多微生物脓毒症期间巨噬细胞中 HMGB1 的乳酸化和乙酰化。
二、结果
临床证据表明,高血清乳酸水平与脓毒症患者的活动度和死亡率相关。与脓毒症对照小鼠相比,给脓毒症小鼠服用乳酸后,血清乳酸水平显著升高 44%(图 1A),HMGB1 水平显著升高 63%(图 1B),而脓毒症小鼠(图 1C)的存活率显著降低。相反,通过特定 LDH 抑制剂恶氨酸钠抑制乳酸生成,显著减轻 CLP 脓毒症,增加 HMGB1(图 1D)和乳酸(图 1A)的血清水平,从而改善脓毒症小鼠的生存结果(图 1C)。这些数据表明,乳酸在脓毒症增加血清 HMGB1 水平和死亡率中起着重要作用。图 1E 显示,与假对照组相比,CLP 脓毒症显著增加了 HMGB1 的血清水平。
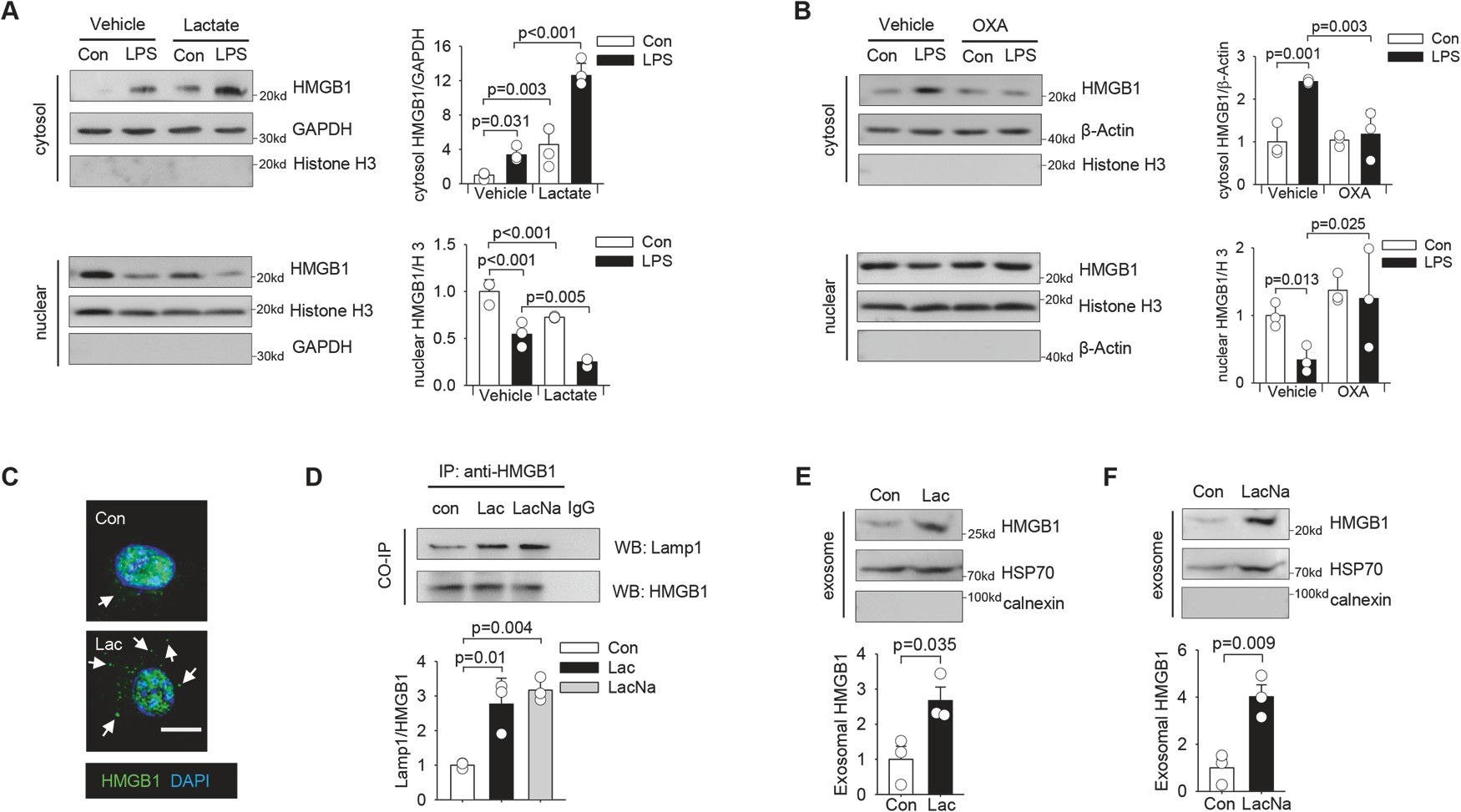
图 1 乳酸水平升高有助于多微生物脓毒症患者循环外体 HMGB1 水平升高
先前的研究表明,活化的巨噬细胞是炎症期间分泌 HMGB1 的主要来源之一。乳酸给药进一步促进了 LPS 刺激的巨噬细胞中 HMGB1 的细胞质定位(图 2A),而草氨酸对内源性乳酸产生的抑制减弱了 LPS 诱导的巨噬细胞中 HMGB1 的细胞质积聚(图 2B)。
这些数据表明,乳酸可以诱导 HMGB1 在细胞质中积累,并促进其定位到溶酶体,然后通过外泌体分泌释放。
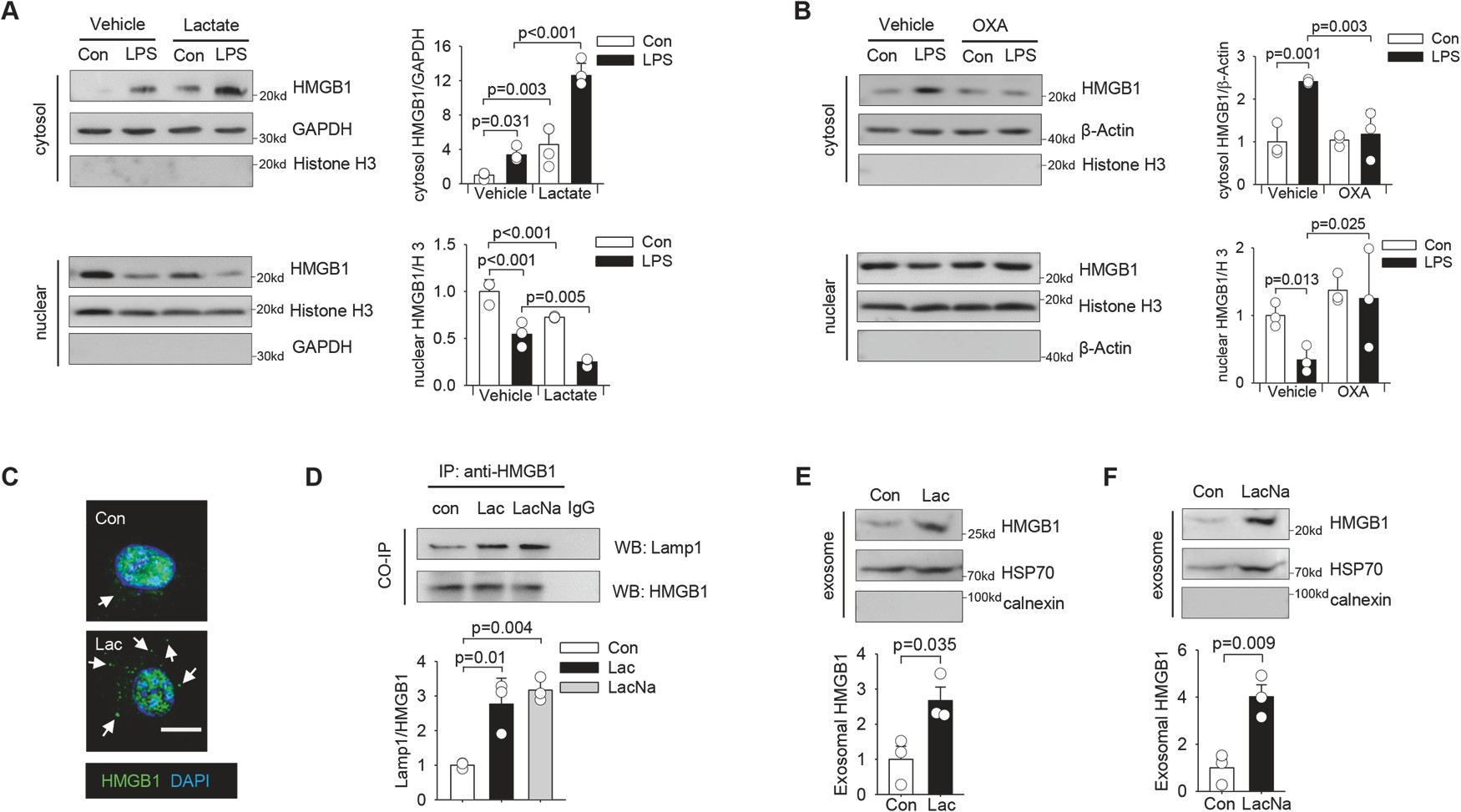
图 2 乳酸通过巨噬细胞外泌体分泌诱导 HMGB1 胞浆积累和释放
乳酸直接促进巨噬细胞中 HMGB1 的乳酸化。我们发现 LPS 强烈升高 HMGB1 免疫复合物中的 Klac 水平(图 3A)。我们一致地观察到,CLP 脓毒症小鼠分离的腹腔巨噬细胞的乳酸化 HMGB1 水平升高(图 3B)。图 3F 显示,C646 减毒乳酸抑制 p300/CBP 的酶活性可增加 HMGB1 免疫复合物中的 Klac 水平。类似地,通过特异性 siRNA 沉默 p300 或 CBP 也可以减弱巨噬细胞中乳酸诱导的 HMGB1 乳酸化(图 3 G)。这些数据表明,乳酸可以通过 p300/CBP 依赖的机制直接诱导核 HMGB1 乳酸化,这可能是 HMGB1 从细胞核向细胞质易位的原因。
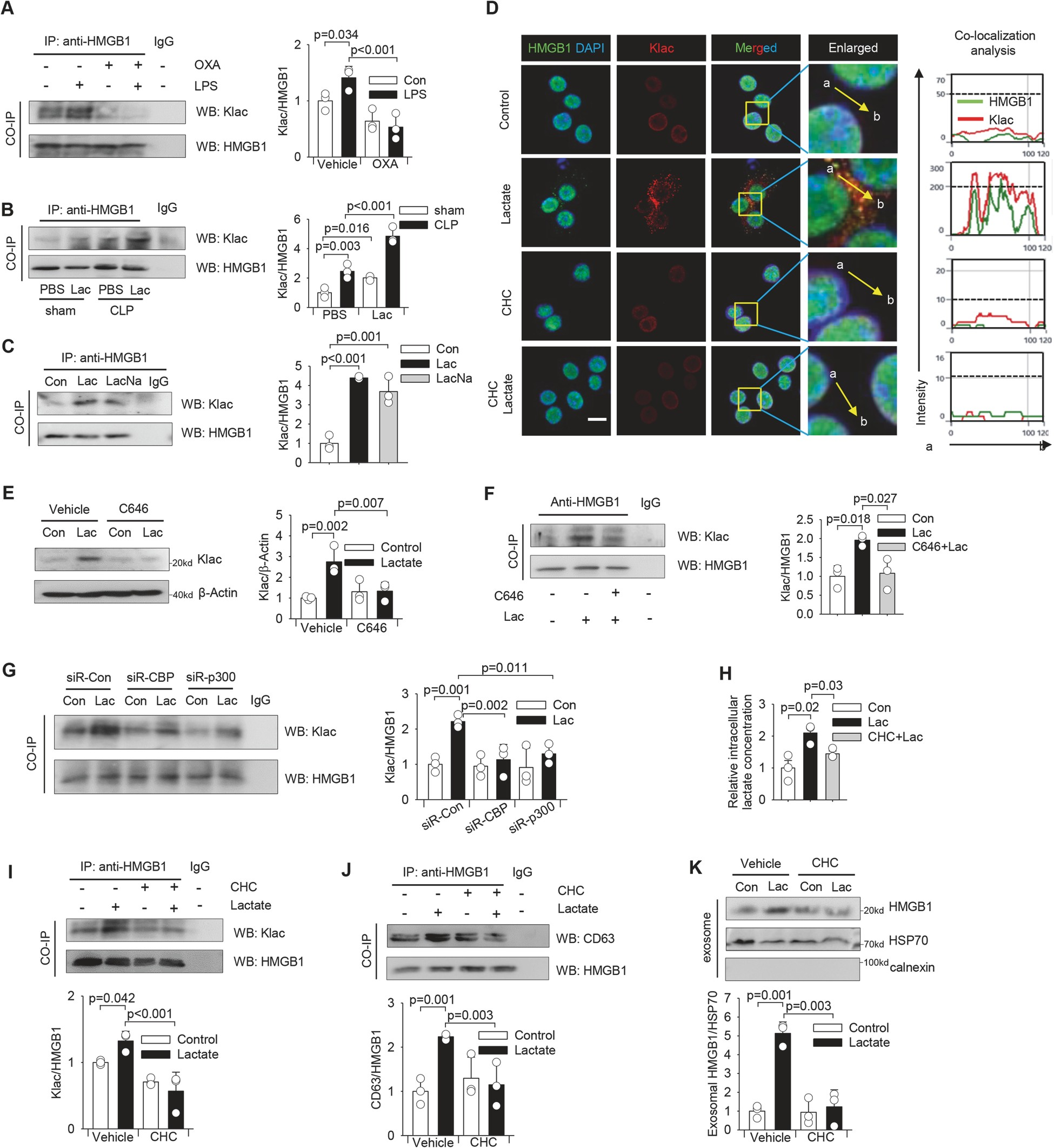
图 3 乳酸直接诱导巨噬细胞 HMGB1 乳酸化(Klac)
为了深入了解乳酸是否也能促进 HMGB1 乙酰化释放,我们在乳酸治疗后通过免疫沉淀检测 HMGB1 中赖氨酸乙酰化(Kac)水平。
如图 4A 所示,乳酸处理显著增加 HMGB1 免疫复合物中的 Kac,表明乳酸促进 HMGB1 赖氨酸乙酰化。使用特定的抗乳酸 HMGB1 抗体,我们观察到在乳酸刺激下 HMGB1 中赖氨酸 12 和 29 残基的乙酰化水平增加(图 4B)。
这些数据表明乳酸刺激 HMGB1 乙酰化,并促进 HMGB1 从巨噬细胞的细胞核转移到细胞质。
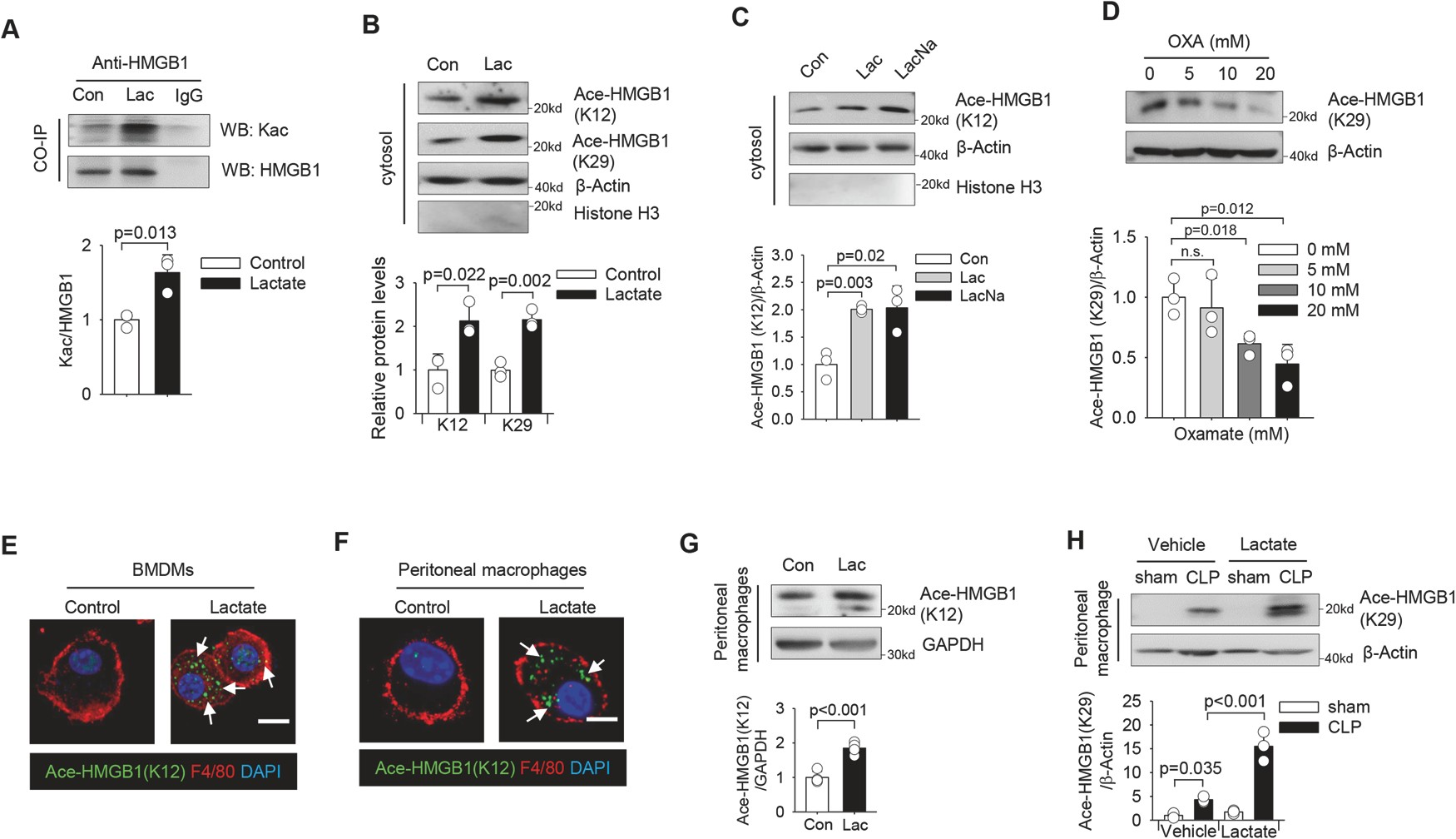
图 4 乳酸诱导 HMGB1 乙酰化
数据表明,乳酸处理显著降低巨噬细胞中细胞质和核 SIRT1 的水平(图 5A),表明 SIRT1 可参与乳酸诱导的 HMGB1 乙酰化。事实上,特异性 SIRT1 脱乙酰酶抑制剂 selisistat(EX527)对 SIRT1 脱乙酰酶活性的抑制显著增加了 HMGB1 乙酰化(图 5B)。
这些数据表明,乳酸抑制 SIRT1 脱乙酰酶的表达,从而使巨噬细胞中 HMGB1 乙酰化/脱乙酰化的平衡向乙酰化方向倾斜。
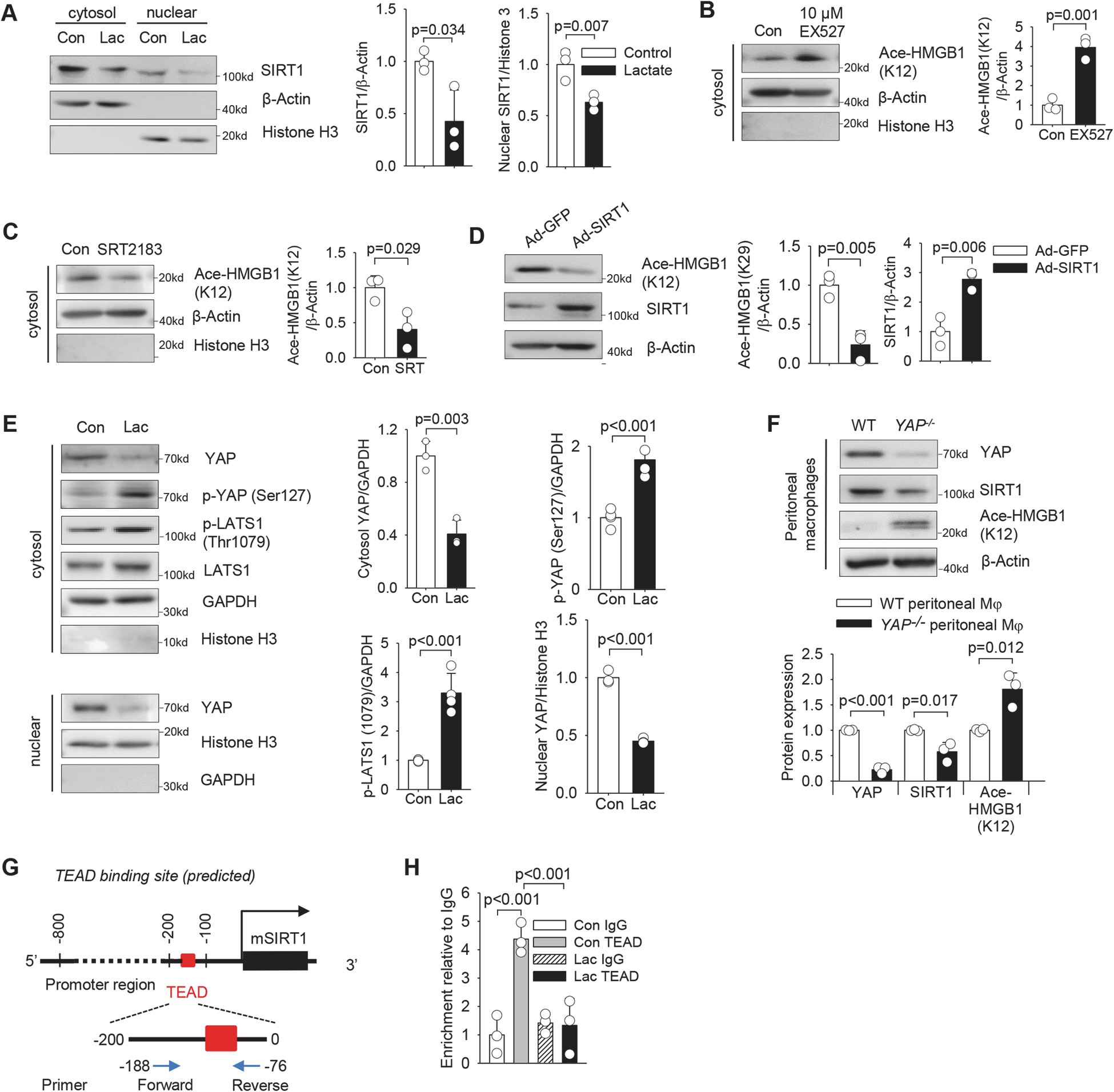
图 5 乳酸通过 YAP 介导的对巨噬细胞脱乙酰酶 SIRT1 的抑制促进 HMGB1 乙酰化
接下来,研究了给予乳酸后赖氨酸乙酰化酶的表达,并观察到乳酸处理显著增加了 p300 的转录水平(图 6A),并增加了 p300 和 CBP 的胞浆和核蛋白水平(图 6B)。如图 6D 所示,抑制 p300/CBP 乙酰化酶活性显著减弱了乳酸诱导的细胞溶质中乙酰化 HMGB1 水平的增加。
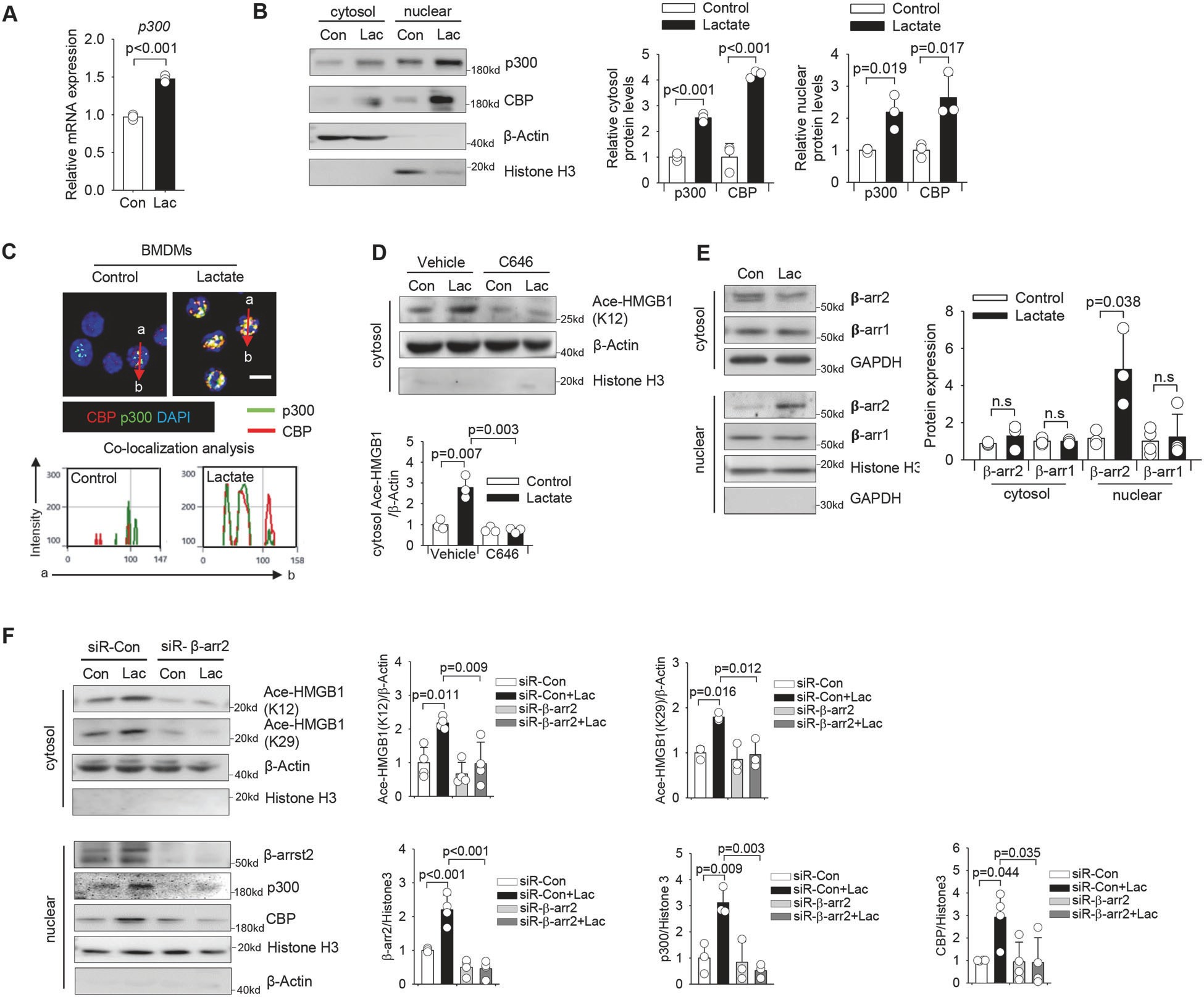
图 6 乳酸通过巨噬细胞中乙酰化酶 p300/CBP 的 β-arrestin2 依赖性招募促进 HMGB1 乙酰化
为了研究 GPR81 在乳酸诱导的 HMGB1 乙酰化中的作用,我们在乳酸治疗前 2 小时用 GPR81 拮抗剂(3-OBA)治疗巨噬细胞。
图 7A 显示,GPR81 抑制减弱了乳酸诱导的巨噬细胞中 β-arrestin2、p300 和 CBP 的核积聚。GPR81 抑制还可阻止乳酸诱导的 LATS1 和 YAP 磷酸化,并保留巨噬细胞中 YAP 的表达(图 7B)。
总之,这些数据证明 GPR81 通过 β-arrestin2 介导的 p300/CBP 乙酰化酶的招募和 YAP 依赖性抑制细胞核中 SIRT1 脱乙酰化酶,在乳酸促进的 HMGB1 乙酰化中发挥重要作用。
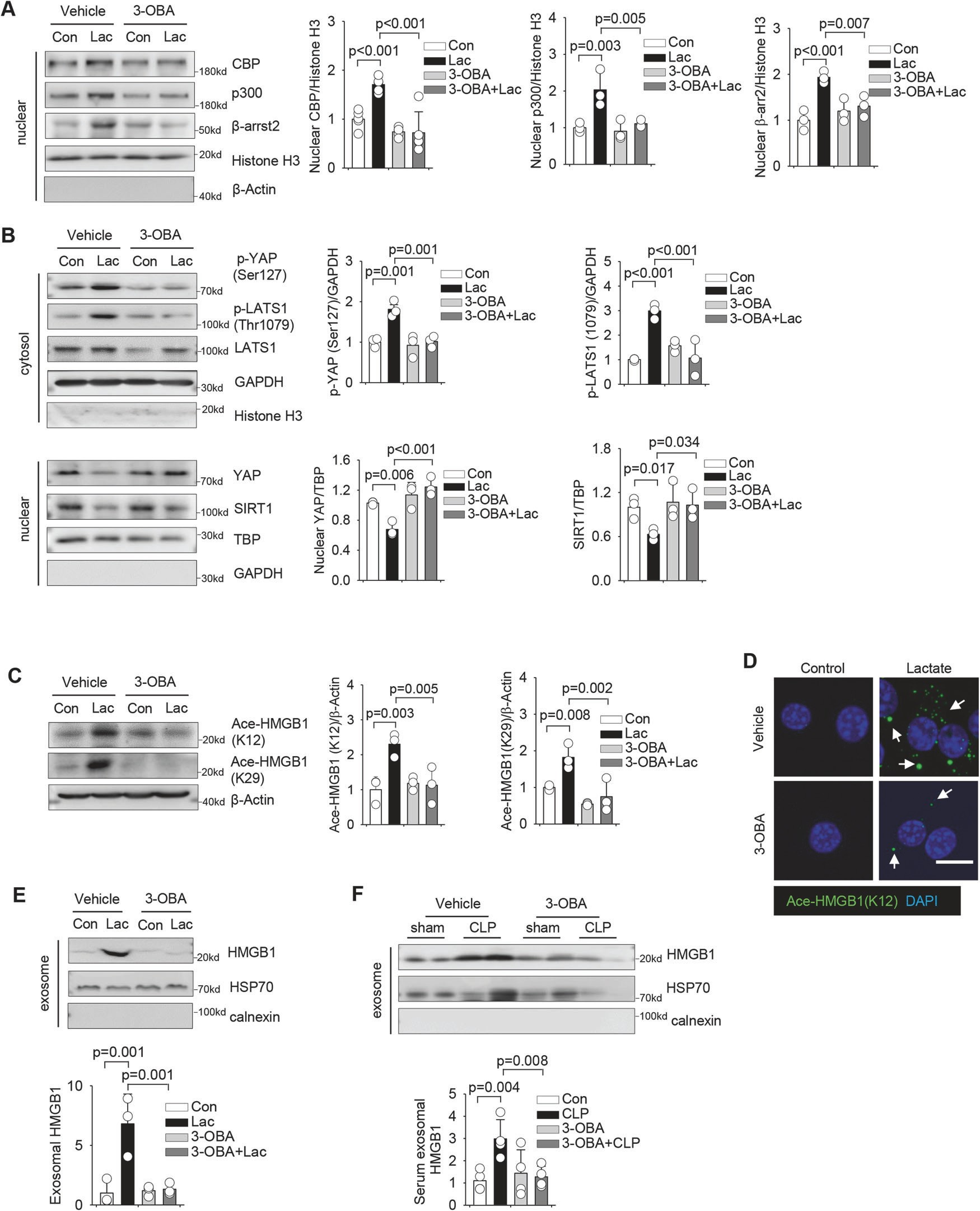
图 7 乳酸诱导的 HMGB1 乙酰化由 GPR81 信号传导介导
此外,乳酸处理的巨噬细胞的外质体显著增加了内皮细胞的通透性,而对照巨噬细胞的外质体没有这种作用(图 8B)。相反,在外小体富集之前,巨噬细胞中 HMGB1 的特异性 siRNA 沉默(图 8C)可保护 HMGB1 免受外小体 HMGB1 的影响,从而降低 VE 钙粘蛋白和 Claudin 5 的表达,外小体 HMGB1 可诱导内皮细胞中 ICAM1 的表达。
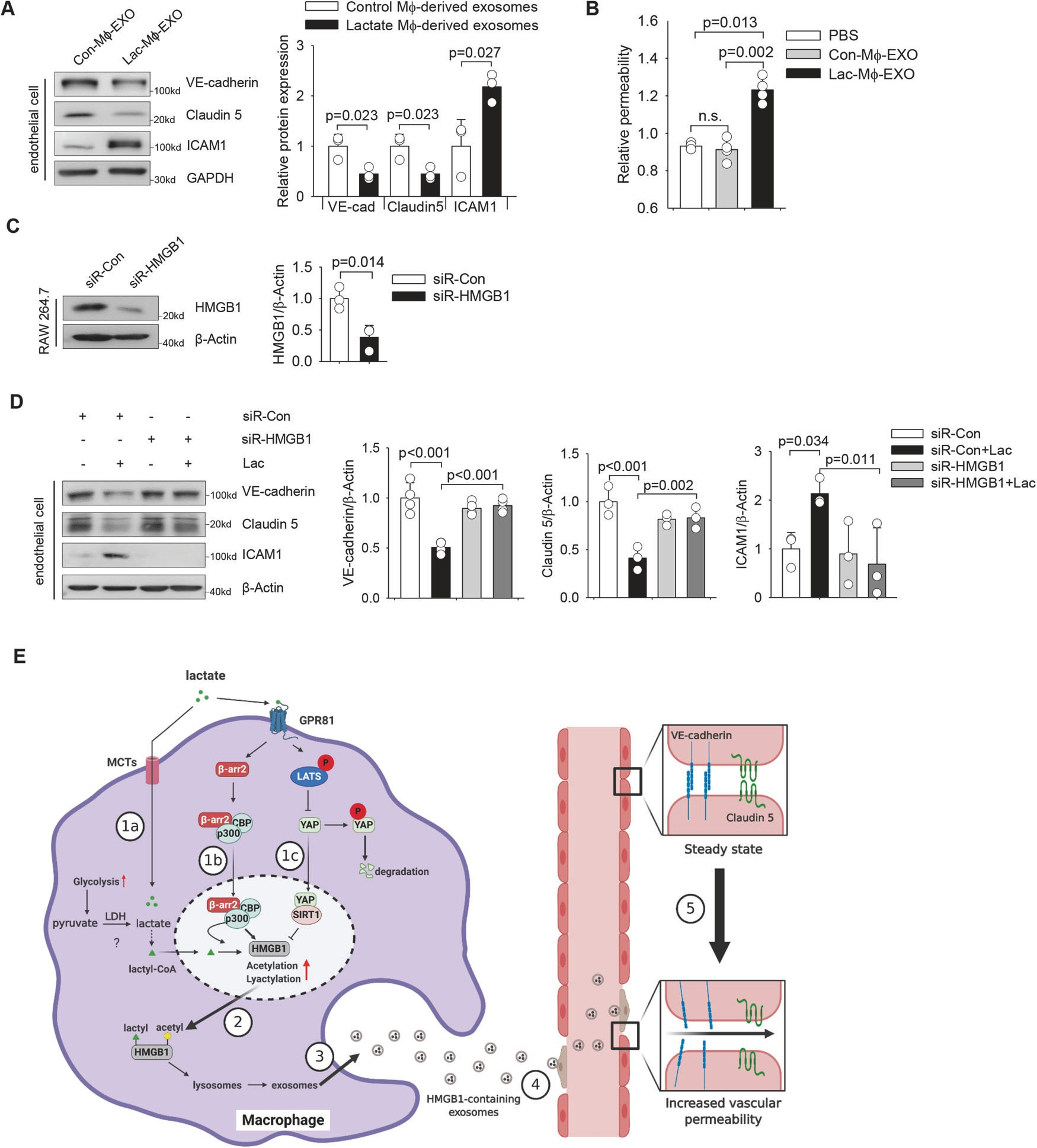
图 8 巨噬细胞源性外体 HMGB1 诱导内皮功能障碍
三、结论
研究证明了乳酸通过巨噬细胞外泌体分泌促进 HMGB1 乳糖化/乙酰化和释放的新作用。乳酸通过向 HMGB1 的赖氨酸残基引入丙交酯基直接参与 HMGB1 的丙交酯化,赖氨酸残基取决于 p300 乙酰化酶的活性。
然后,乳酸化/乙酰化 HMGB1 从细胞核转移到细胞质,然后通过外泌体分泌释放到循环中,分泌的外体 HMGB1 进一步破坏内皮细胞的完整性并增加血管通透性。
综上所述,该研究通过促进 HMGB1 的释放,为乳酸在脓毒症期间的有害作用提供了新的机制基础。数据表明,糖酵解衍生的乳酸和乳酸相关信号可能是抑制巨噬细胞释放 HMGB1 和改善多微生物脓毒症生存结果的潜在靶点。
参考文献
[1] Zhang D, Tang Z, Huang H, Zhou G, Cui C, Weng Y, Liu W, Kim S, Lee S, Perez-Neut M, Ding J, Czyz D, Hu R, Ye Z, He M, Zheng YG, Shuman HA, Dai L, Ren B, Roeder RG, Becker L, Zhao Y. Metabolic regulation of gene expression by histone lactylation. Nature. 2019; 574 (7779):575-580.
[2] Liberti MV, Locasale JW. Histone Lactylation: A New Role for Glucose Metabolism. Trends Biochem Sci. 2020; 45 (3):179-182.
[3] Hagihara H, Shoji H, Otabi H, Toyoda A, Katoh K, Namihira M, Miyakawa T. Protein lactylation induced by neural excitation. Cell Rep. 2021; 37 (2):109820.
[4] Yu J, Chai P, Xie M, Ge S, Ruan J, Fan X, Jia R. Histone lactylation drives oncogenesis by facilitating m(6)A reader protein YTHDF2 expression in ocular melanoma. Genome Biol. 2021; 22 (1):85.
[5] Yang K, Fan M, Wang X, Xu J, Wang Y, Tu F, Gill PS, Ha T, Liu L, Williams DL, Li C. Lactate promotes macrophage HMGB1 lactylation, acetylation, and exosomal release in polymicrobial sepsis. Cell Death Differ. 2022; 29 (1):133-146