百致生物医药科技(上海)有限公司
9 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 1.2000000000000002
- 0.20000000000000018
推荐产品
公司新闻/正文
双硫死亡-二硫化物应激介导的细胞死亡方式
9404 人阅读发布时间:2024-07-29 12:05
双硫死亡,作为一种新兴且独特的细胞死亡类型,正逐渐揭开其神秘的面纱。研究报道了由过量胱氨酸积累引发的二硫化物应激所导致的一种新型细胞死亡方式——双硫死亡。其发生机制与特定的转运蛋白密切相关。
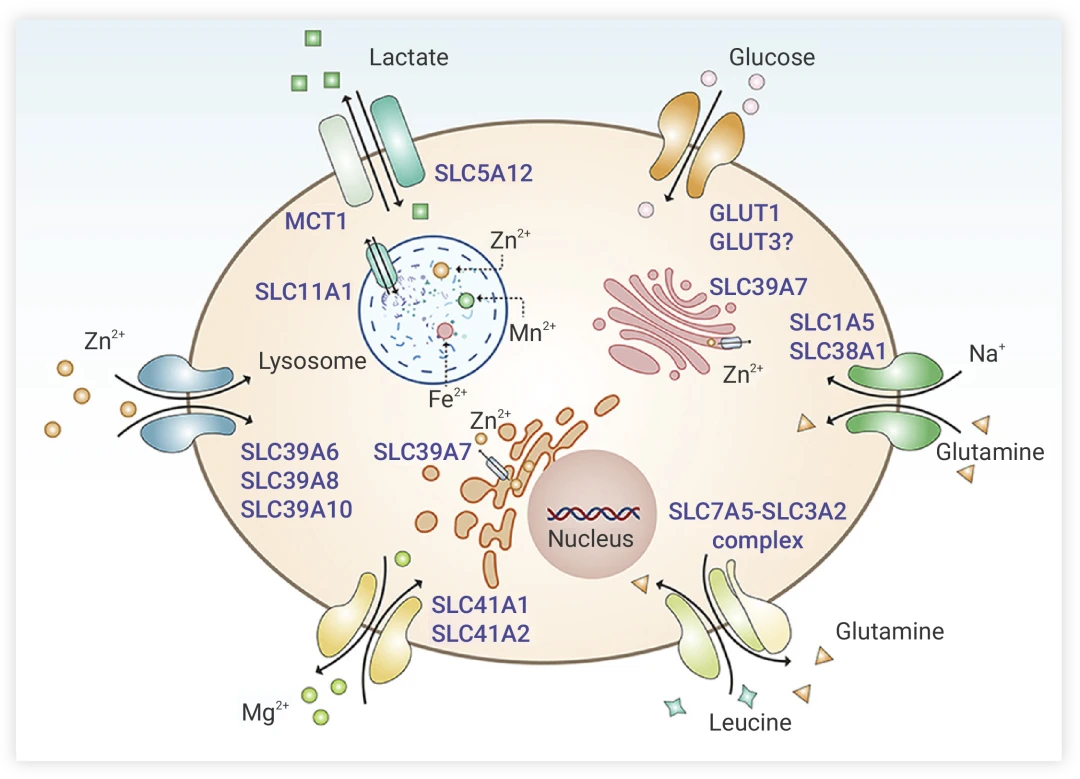
图1SLC转运蛋白家族对不同离子和氨基酸等转运
SLC7A11——双刃剑效应:促进生存与诱导死亡
其中最主要的是溶质载体家族成员SLC7A11(Solute Carrier Family 7 Member 11,也被称为xCT)。
SLC7A11是一种胱氨酸/谷氨酸逆向转运蛋白,它能够将细胞外的胱氨酸转运至细胞内,并在细胞内通过消耗NADPH将其还原为半胱氨酸。半胱氨酸是GSH合成的限速前体,而GSH是细胞内最重要的抗氧化剂之一,能够清除自由基和过氧化物,从而保护细胞免受氧化应激的损害。
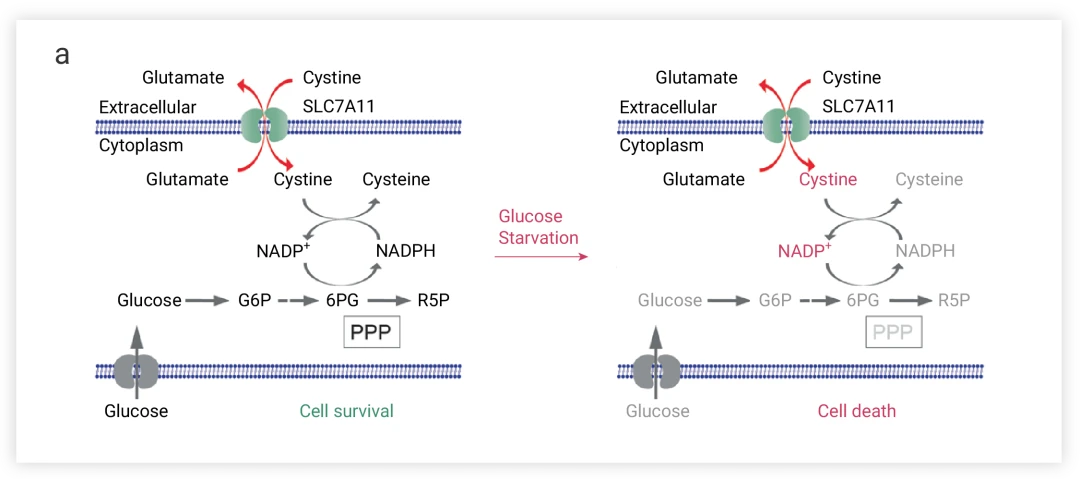
图2葡萄糖饥饿条件下,高SLC7A11表达反而促进细胞死亡。
SLC7A11和SLC3A2组成的胱氨酸/谷氨酸逆向转运蛋白SystemXc-,将胞内谷氨酸转出以1:1的比例来换取胞外的胱氨酸(Cys2)
● 促生存作用:在正常情况下,SLC7A11通过其转运功能,确保细胞能够获得足够的半胱氨酸以合成GSH,从而维持细胞的氧化还原稳态和存活。
● 诱导死亡作用:然而,在某些特定条件下,如葡萄糖饥饿,SLC7A11的高表达可能反而促进细胞死亡。
这是因为胱氨酸是种不溶性氨基酸,为了防止细胞内高度不溶性胱氨酸的毒性积聚,SLC7A11high细胞需要迅速将胱氨酸还原为半胱氨酸,而这个过程需要从葡萄糖-戊糖磷酸途径(PPP)获得大量NADPH,这会对细胞NADPH库会造成大量消耗,并使此类细胞产生葡萄糖和戊糖磷酸途径(PPP)依赖性(如图2)。因此,当葡萄糖供应限制,氧化还原力不足,SLC7A1high细胞内的胱氨酸或其他二硫化物分子的异常积累,诱发二硫化物应激触发细胞死亡。
双硫死亡——独特细胞死亡形式
双硫死亡作为一种新兴的细胞死亡模式,显著区别于传统的铁死亡、凋亡及细胞坏死等机制。在SLC7A11高表达的细胞模型中,即便应用铁死亡、凋亡、细胞坏死以及自噬的特异性抑制剂,均未能有效阻止由葡萄糖饥饿触发的细胞死亡现象(如图3a-b所示)。然而,令人瞩目的是,二硫应激的特定还原剂——如二硫苏糖醇(DTI)、β-巯基乙醇(2ME)及TCEP,能够全面遏制这种在SLC7A11高表达且处于葡萄糖饥饿状态下的细胞死亡(图3d)。
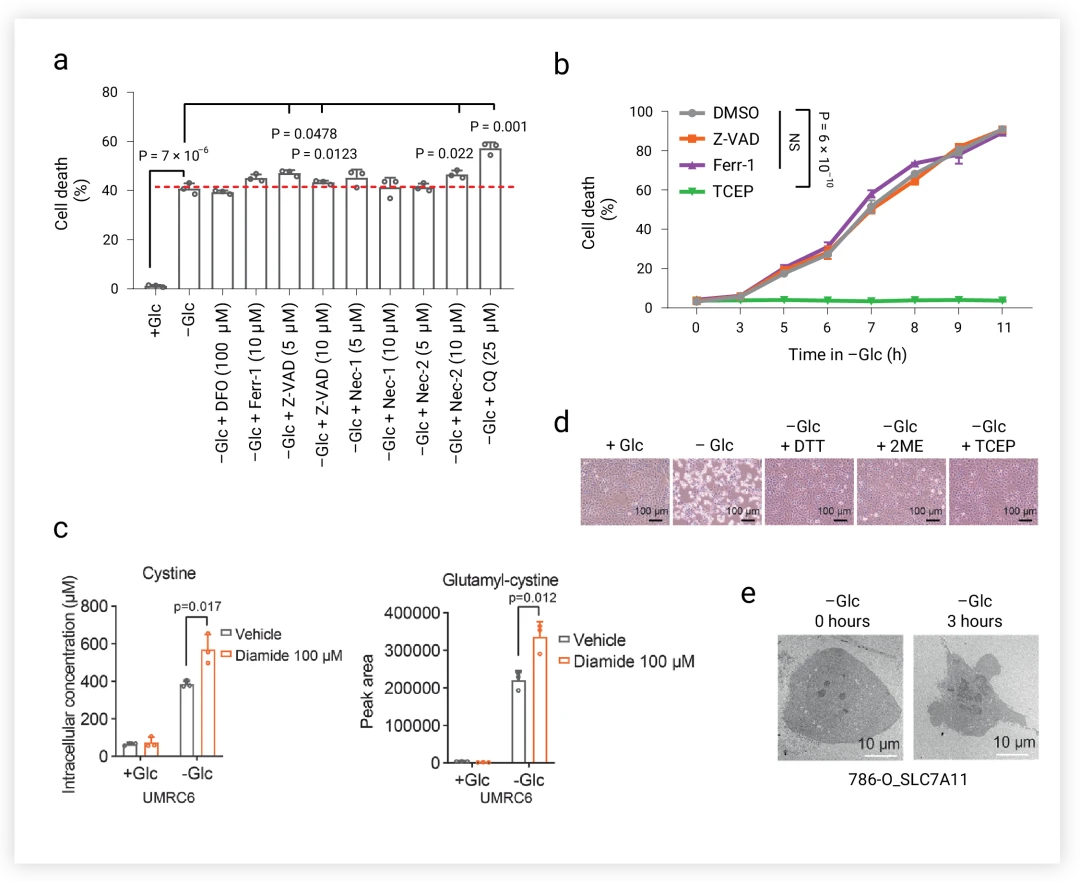
图3.葡萄糖饥饿条件下的细胞死亡方式。
a.SLC7A11-high细胞用DFO,Fer-1.Z-VAD,Nec-1.Nec-2和CQ处理后的细胞死亡情况。b.过表达SLC7A11的细胞在无葡萄糖培养基中用Z-VAD,Fer-1和TCEP处理指定时间。c.UMRC6细胞在含或不含DTT,2ME或TCEP的培养基中培养。d.UMRC6细胞内胱氨酸和谷氨酰胱氨酸的积累。e.UMRC6细胞的典型透射电镜图像。
进一步地,研究发现硫醇氧化剂(如二胺和马来酸二乙酯)非但未能保护细胞,反而加剧了SLC7A11高表达细胞在葡萄糖饥饿条件下的死亡,并显著促进了细胞内二硫键连接分子的迅速累积(特别是胱氨酸与谷氨酰胱氨酸,且二胺处理加剧了这一趋势)(图3c)。透射电子显微镜的深入观察揭示了葡萄糖饥饿诱导下,SLC7A11高表达细胞内胱氨酸在细胞质中的显著积聚(图3e)。
上述发现强烈暗示,二硫胁迫所介导的细胞死亡具有其独特的生物学特征和分子机制,与已知的铁死亡、细胞凋亡等过程截然不同。因此,探索并界定这一新型细胞死亡模式的标志性特征及其背后的分子机制,成为了当前细胞生物学领域亟待解决的重大课题。
双硫死亡--与肌动蛋白细胞骨架有关
在葡萄糖饥饿的情境下,我们假设SLC7A11高表达细胞的NADPH耗竭与二硫应激的加剧共同促进了氧化还原敏感蛋白质中二硫键的形成。通常情况下,细胞质内的还原环境能有效防止胞质蛋白形成二硫键,但在此特殊条件下,二硫键的生成可能破坏目标氧化蛋白的活性与功能,进而削弱细胞的生命力。
为验证这一假设,研究团队采用氨基酸稳定同位素标记技术,精准量化了葡萄糖饥饿状态下SLC7A11高表达细胞中发生的二硫化物蛋白质组变化(图4a)。通过正向与反向标记分析,成功识别出90个关键半胱氨酸位点。进一步,基因本体分析揭示了这些二硫键标记的蛋白质显著富集于肌动蛋白细胞骨架构建及细胞粘附相关的生物过程与途径中(图4c)。
团队鉴定出至少17种肌动蛋白细胞骨架蛋白在葡萄糖饥饿后展现出显著的二硫键增加(图4b)。深入分析发现,这些蛋白质中的大多数均包含参与形成二硫键的半胱氨酸位点(图4d-e),直接证实了SLC7A11高表达细胞在葡萄糖饥饿条件下,肌动蛋白细胞骨架蛋白中二硫键形成的假设(图4c)。
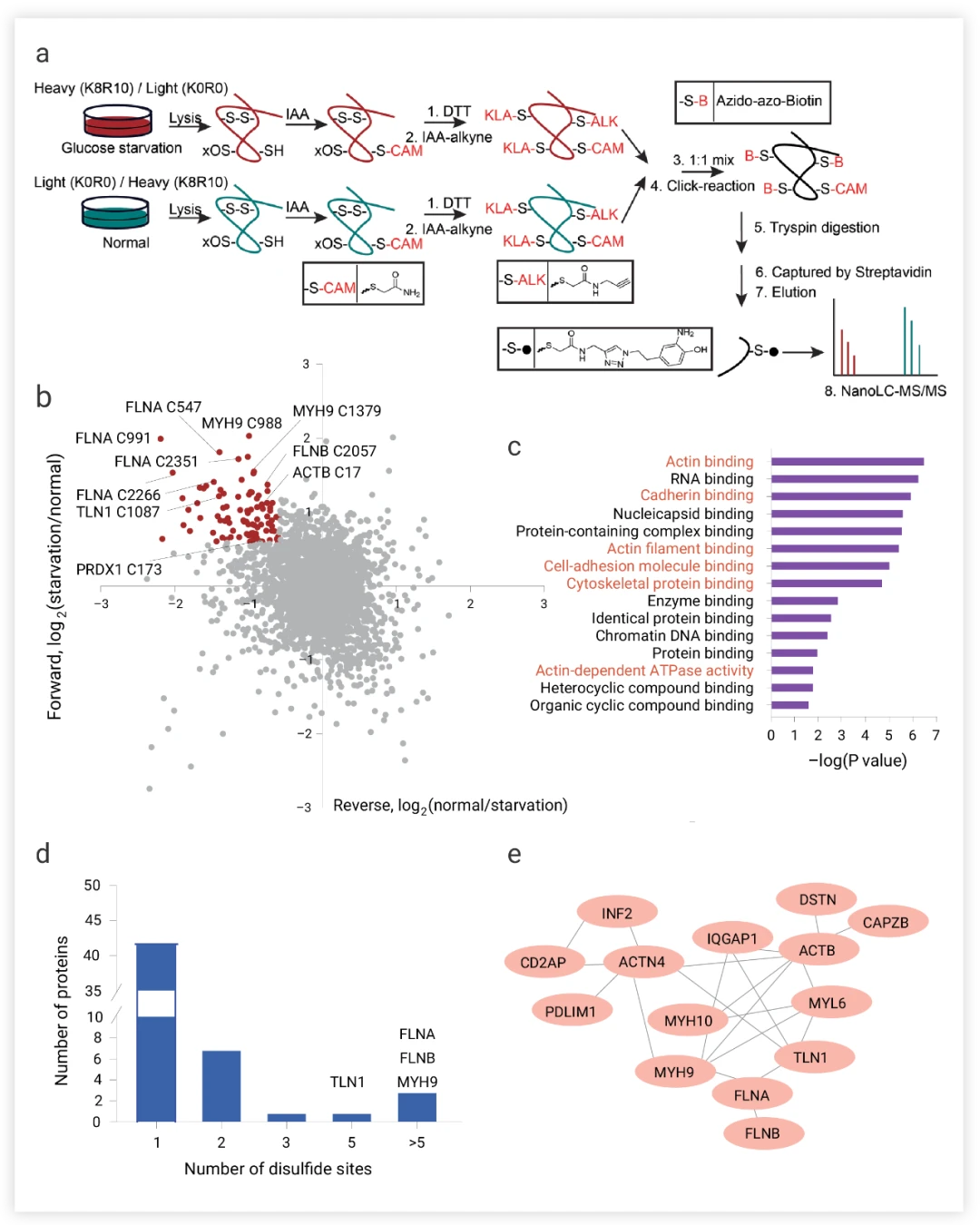
图4.葡萄糖饥饿条件下肌动蛋白细胞骨架蛋白中的二硫键形成。
a.用于鉴定含二硫肽的方法 正向和反向实验中含二硫肽的散点图。c.基因本体(GO)富集分析。d.含有二硫键的蛋白质的不同含二硫半胱氨酸位点的数量的增加。
细胞的肌动蛋白细胞骨架动力学
研究团队通过电泳迁移率分析,发现UMRC6细胞在葡萄糖饥饿后,多个肌动蛋白细胞骨架蛋白迁移减缓,暗示其形成了分子间二硫键(图5a)。进一步探究SLC7A11高表达细胞在葡萄糖饥饿下的肌动蛋白骨架动态,结果显示,正常条件下F-肌动蛋白分布于细胞皮质和应激纤维,而饥饿则导致细胞及F-肌动蛋白收缩,且F-肌动蛋白与质膜分离(图5b-d)。这些变化依赖于SLC7A11表达,且能被胱氨酸饥饿、2DG或2ME逆转(图5f)。
葡萄糖饥饿诱导的SLC7A11高细胞肌动蛋白骨架蛋白异常二硫键可能导致随后的F-肌动蛋白收缩和脱离质膜。
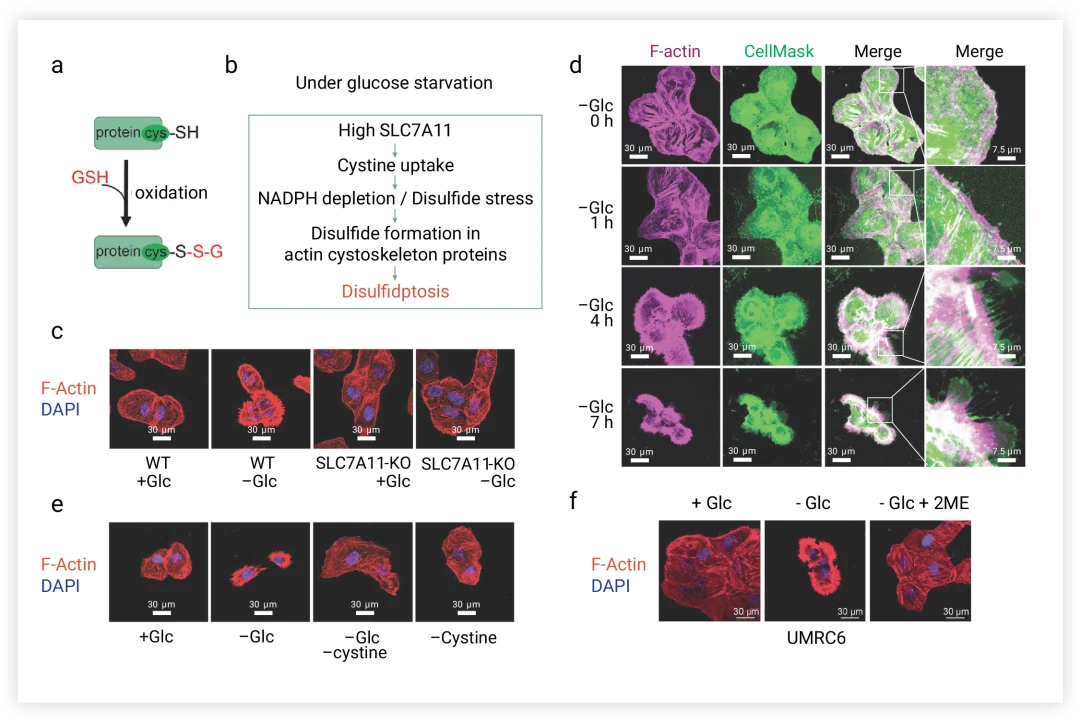
图5.葡萄糖饥饿条件下,异常二硫键形成导致的肌动蛋白动力学。
a-b.GSH化SLC7A11-high介导的胱氨酸摄取示南图。c.WT和SLC7A11-KO UMRC6细胞的无糖培养基中对F-肌动蛋白进行荧光染色。d.无糖培养基中培养的细胞的F-肌动蛋白和膜进行荧光染色。e.含葡萄糖、无葡萄糖、葡萄糖和无胱氨酸(-Gle)培养基中培养,对F-肌动蛋白进行荧光染色。f.2ME添加在含糖或无糖培养基中培养的细胞中F-肌动蛋白的荧光染色。
双硫死亡的研究意义
葡萄糖,作为糖酵解过程的起始原料,其跨膜转运依赖于葡萄糖转运蛋白(GLUT)家族的精密调控。鉴于GLUT在癌细胞代谢中的核心作用,它已成为探索癌治疗新策略的迷人靶点。
甘波谊团队等人在2020年的发表的文章中就发现高SLC7A11表达的癌细胞对葡萄糖转运蛋白GLUT抑制剂特别敏感。GLUT抑制剂KL-11743或Bay-876可有效抑制葡萄糖摄取,与葡萄糖饥饿情况相似。在SLC7A11过表达细胞中,GLUT1抑制剂处理增加NADP+/NADPH比值(图6a,b),并在UMRC6细胞中引发强烈的细胞死亡(图6c)。此外,GLUT抑制会诱导二硫键的结合肌动蛋白骨架蛋白和F-肌动蛋白网络崩溃。
在动物模型中,Bay876治疗降低了SLC7A11high NCl-H226异种移植瘤的生长(图6d),Bay-876处理的肿瘤表现出频繁的细胞死亡(图6e),Bay-876处理的肿瘤在肌动蛋白细胞骨架蛋白中表现出更多的二硫键结合。这些结果表明:GLUT抑制剂诱导SLC7A1high癌细胞的双硫状态和细胞死亡,而癌细胞的双硫死亡可能是介导GLUT抑制剂治疗SLC7A11high肿瘤的治疗效果的关键因素。
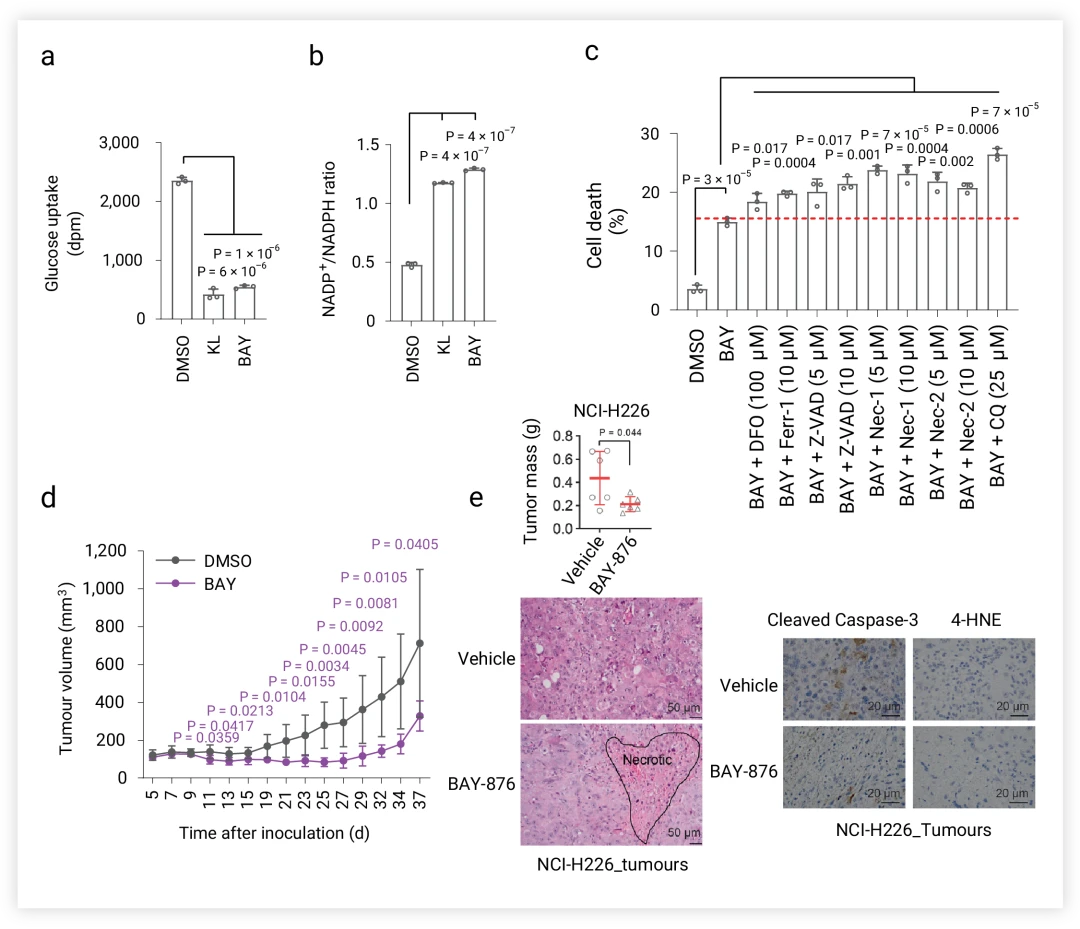
图6.GLUT抑制剂诱导SLC7A11高表达细胞死亡。
a,葡萄糖摄取水平。b.NADP+/NADPH比值 c.死亡细胞的比例。BAY-876与DFO,fer-1,Z-VAD、Nec-1、Nec-2和CQ在指定浓度下处理7h。d.NCI-H226异种移植模型中肿瘤体积随时间的变化。e.NCI-H226异种移植物的重量以及NCI-H226肿瘤区域的HE柒色和免疫组化染色。
我司可提供双硫死亡相关检测实验,具体请联系我们。