百致生物医药科技(上海)有限公司
9 年
手机商铺
- NaN
- 0.20000000000000018
- 0.20000000000000018
- 1.2000000000000002
- 0.20000000000000018
推荐产品
公司新闻/正文
癌症治疗新方向—使用靶向脂质纳米颗粒进行 CRISPR-Cas9 基因组编辑
2743 人阅读发布时间:2022-07-27 17:23
利用 CRISPR-Cas9 技术进行癌症治疗一直受到肿瘤编辑效率低和现有传递系统潜在毒性的阻碍。
今天我们来讨论一种安全有效的脂质纳米颗粒 (LNP),它使用一种新型的氨基电离脂质来传递 Cas9 mRNA 和 sgRNAs。单次脑内注射针对 PLK1 的 CRISPR-LNPs (sgPLK1-cLNPs) 到侵袭性原位胶质母细胞瘤中,可使体内高达 70% 的基因编辑,导致肿瘤细胞凋亡,抑制肿瘤生长 50%,提高 30% 的存活率。为了达到弥散性肿瘤,cLNPs 也被设计为抗体靶向输送。腹腔注射靶向 egfr 的 sgPLK1-cLNPs 可使其选择性摄取到播散性卵巢肿瘤中,可使体内高达 80% 的基因编辑,抑制肿瘤生长,提高 80% 的存活率。
破坏肿瘤体内基因表达的能力为癌症治疗、研究和非癌组织靶向基因编辑的潜在应用开辟了新的途径。
近年来,分子靶向抑制剂和免疫治疗大大改善了肿瘤反应,减少了毒性和不良反应。然而,大多数类型癌症的高复发率和耐药性的发展突出了对新的治疗方式的需要。大多数癌症药物需要反复给药,这增加了治疗相关的毒性和治疗成本,严重降低了患者的生活质量。

CRISPR- Cas9 基因编辑具有破坏肿瘤生存基因的潜力,它可以克服传统癌症治疗的重复剂量限制,提高治疗效果,并需要更少的治疗。Cas9 核酸酶是由 single-guide RNA (sgRNA) 修改特定染色体 DNA 序列通过诱导 sequence-specific 双链断裂 (双边带)。双边带主要是解决通过出错 nonhomologous end-joining 修复机制, 它可以诱发插入或删除, 导致基因破坏。然而,Cas9 (160 kDa, 4300 碱基) 和 sgRNA (~31 kDa, 130 碱基) 的大尺寸是传统病毒和非病毒给药系统的障碍。此外,目前用于非肝组织和肿瘤的传递系统只导致相对较低的基因编辑百分比。为了有效的癌症治疗,需要大幅提高编辑效率。
脂质纳米颗粒 (LNPs) 是临床批准的非病毒核酸输送系统,有可能输送如此大的有效载荷。阳离子可电离脂质是 LNPs 的关键成分,可实现高效的核酸封装、细胞传递和内体释放。然而,LNP 配方优化的小干扰 RNA (siRNA) 交付不有效地提供大量的核酸 (例如,mrna 和质粒)。大多数基因的体内研究编辑依靠腺相关病毒 (AAV) 交付 CRISPR 组件局部视网膜或骨骼肌和肝脏。不过,AAV 的应用受到其小容量、免疫反应、高剂量下的肝毒性和缺乏细胞靶向性的限制。
近年来已经报道了几种用于 CRISPR 成分的非病毒载体。这些系统对肝脏相关的遗传疾病进行了评估,证明在小鼠和大鼠肝脏中可以进行高达 60% 的基因编辑,而且血液中的目标蛋白几乎完全减少。然而,为其他组织设计的配方效率较低 (即,在肺中高达 15%,在黑素瘤中为 3%)。因此,开发高效、安全的非肝组织传递系统仍然是 CRISPR 编辑治疗转化的重要缺失环节。
本文探讨一种用于治疗性基因组编辑的靶向非病毒 LNP 传递系统的开发,并在两种侵袭性和不可治愈的癌症模型中对其进行评估。
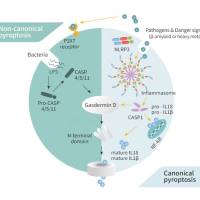
首先来看包埋 Cas9 mRNA 和 sgRNA 的 LNPs 的开发和特征。为了克服目前可用 LNP 配方的货物限制,设计了 LNPs 来包埋 Cas9 mRNA 和 sgRNA,使用的是来自一个新的可电离氨基脂质库的电离阳离子脂质 (图 1A)。该文库是用一种新型的离子化氨基脂类构建的,具有亚油酸链和胺头基团。脂质 1、6、8 和 10 是屏幕上最热门的,并被选择用于进一步评估 CRISPR-Cas9 基因编辑 (图 1B)。
我们选择了 Cas9 mRNA,而不是质粒 DNA,以减少对核酸酶的长期暴露,以减少脱靶基因的修饰。为了提高 RNA 的稳定性和降低免疫原性,用 5-甲氧基尿苷对 Cas9 mRNA 进行化学修饰,并使用高度修饰的 sgRNA (IDT sgRNA XT)。将含有 Cas9 mRNA 和 sgRNA 的 CRISPR-LNP (cLNP) 配方与临床批准的 LNP 配方包埋的 Cas9 mRNA 和 sgRNA 进行比较,LNP 配方用于 siRNA 治疗,基于 DLin-MC3-DMA 作为可离子阳离子脂质 (MC3-cLNPs)。
▲图 1
图 1C:通过动态光散射测量,cLNPs 尺寸均匀,直径为 71 ~ 80 nm,多分散指数为 0.024 ~ 0.103,z 电位为−3 ~ 18.6 mV。
图 1C 和图 S1A:L8-cLNPs 的生物物理性质和透射电镜照片与 MC3-cLNPs 相似。
图 1D:在 L6、L8、L10 和 MC3-LNPs 中,Cas9 mRNA 和 sgRNA 的封装效率同样高 (>90%),但在 L1-cLNPs 中较低 (~65%)。
图 1E:研究评估了 cLNP 制剂的体外基因破坏效率通过测量稳定表达 GFP 的人胚胎肾 (HEK) 293 细胞中绿色荧光蛋白 (GFP) 荧光的损失来包埋 GFP sgRNA。
图 1 H:研究评估了使用 L8-cLNPs 在多个表达 gfp 的侵袭性癌细胞系 [005 小鼠多形胶质母细胞瘤 (GBM),人浆液性卵巢腺癌 Ovcar8 (OV8) 和 NCI-ADR (NAR),人结肠癌 HCT116 和人肺腺癌 A549] 中的基因破坏。与 sgGFP-cLNPs(1 mg/ml;7 nM 的总 RNA),只有 3 - 18% 的癌细胞检测到 GFP 荧光。因此,L8-cLNPs 在体外对多种癌细胞株进行高效、特异性的基因编辑,且毒性低。
L1-、L8-和 L10-cLNPs 均以浓度依赖性破坏 GFP,其中 L8 破坏效率最高。在 l8 - clnp 处理的细胞与含总 RNA(1.0 mg/ml) 的 cLNPs 孵育后,仅 4% 的细胞检测到 GFP 荧光。虽然通过流式细胞仪检测,cy5.5 标记的 MC3-cLNPs 比 L8- cLNPs 更有效地被 HEK293/GFP 细胞吸收 (图 S1B),但在任何浓度下 (0.1 至 1.0 mg/ml 总 RNA, 0.7 至 7 nM 总 RNA), MC3-cLNPs 都没有降低 GFP 的表达。基于这些数据,我们选择 L8-cLNPs 进行进一步研究。
通过量化下一代测序 (NGS) 中 GFP 基因组序列编辑的百分比,评估 L8-cLNPs 包埋 GFP sgRNAs (sgGFP-cLNPs) 对 HEK293/GFP 基因破坏的效率和特异性。94% 的 GFP 基因组 DNA 被修改,但 <0.1% 在非目标位点 (PLK1) 被编辑 (图 1,F 和 G)。在所有测试浓度下,sgGFP-cLNPs 均不显著影响细胞活力 (高达 1 mG /ml; 图 S2)。
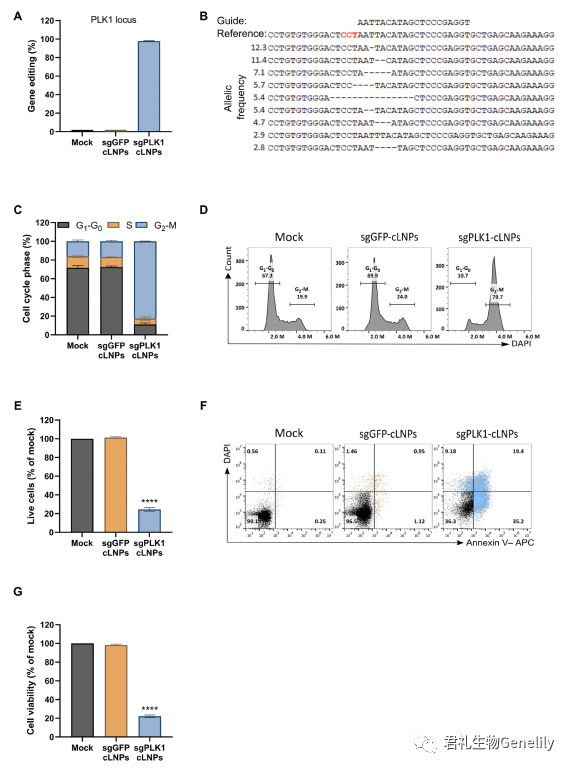
▲图 2
为了探索治疗性基因组编辑的潜力,作为概念证明,我们评估了含有 PLK1 sgRNA (sgPLK1- cLNPs) 或 sgGFP-cLNPs 的 L8-cLNPs 作为对照。PLK1 是有丝分裂所需的激酶; 缺乏它会导致 G2-M 期细胞周期停滞和细胞分裂时死亡。
图 2,A 和 B:用 sgPLK1-cLNPs(0.5 mg/ml) 处理 HEK293/GFP 时,可导致 98% 的 PLK1 基因编辑,而 NGS 对非目标 GFP 位点的 PLK1 基因编辑 <0.1%。
图 2,E to G:PLK1 基因编辑可导致 48 小时后有效的 G2-M 阻滞,而对照 sgGFP-cLNPs 对细胞周期谱没有影响 (经 4 ',6-双二氨基-2-苯基吲哚 (DAPI)/annexin V 染色和 XTT 分析,在处理 96 小时后,与未处理或 sggfp - clnp 处理的培养物相比,sgPLK1-cLNP 处理的细胞活力降低了 5 倍。sgGFP-cLNPs 治疗后保存的细胞活力表明,cLNPs 在治疗相关剂量下可能具有低毒性。
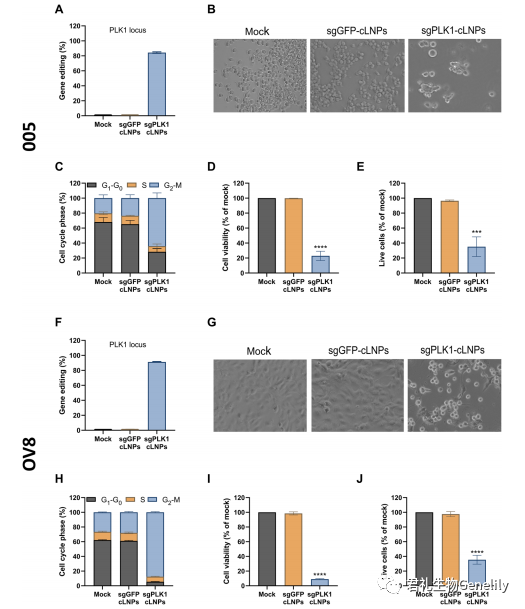
▲图 3
在体外实验中,sgPLK1-cLNP 基因编辑诱导癌症细胞系细胞周期阻滞和细胞死亡我们评估了两种具有侵袭性和难以治疗的癌症细胞系——从 Tp53+/−小鼠胶质瘤中分离的小鼠 GBM 干细胞样 005 细胞系,该细胞系是在激活的 H-Ras 和 Akt 和人类 OV8 的脑内慢病毒转导后形成的。高级别浆液性卵巢腺癌细胞系具有高度耐药性并转移形成腹水。gbm005 细胞几乎与致命的人类 GBM 相似,因为它们具有高侵袭性、新生血管化、多形性和被免疫细胞浸润。腹腔注射 OV8 形成耐化疗,转移性,高级别卵巢癌异种移植,像大多数人类卵巢癌。在 gbm005 或 OV8 与 sgPLK1 而不是 sgGFP 体外孵育时,cLNPs 有效地干扰了 PLK1 基因,分别导致 84 和 91% 的基因组编辑 (图 3、A 和 F、图 S3)。
中断 PLK1 还强烈引起 G2-M 细胞周期阻滞治疗后 48 小时内 (图 3、B、C、G 和 H, 和无花果。S4, A 和 C) 和减少细胞生存能力在治疗后 96 小时在 OV8 GBM 005 年 5 倍和 10 倍, 分别 (图 3 D 和 I)。同样,DAPI 和/或膜联蛋白 V 染色增加与 sgPLK1 孵化后, 而不包括 sgplfp - clnps(图 3,E 和 J,图 S4, B 和 D)。因此,sgPLK1-cLNPs 有效地破坏了靶向基因,导致 GBM 005 和 OV8 细胞周期阻滞和体外死亡。为了评估 cLNPs 对癌症的治疗潜力,我们需要解决关于 CRISPR-Cas9 疗法的两个主要问题: 潜在毒性和免疫原性。一项初步研究评估了 C57BL/6 小鼠静脉注射 sgGFP-cLNPs (1 mg/kg) 24 小时后的肝脏毒性、血液计数和血清炎症因子。没有明显的毒性临床迹象,肝酶 (谷丙转氨酶、天冬氨酸转氨酶和碱性磷酸酶) 水平或血液计数也没有显著差异。血浆细胞因子组 [白细胞介素-1b(IL-1b),IL-2,肿瘤坏死因子-a(TNF-a),干扰素-g(IFN-g) 和 IL-10] 也显示无显著差异。虽然临床前开发需要对潜在毒性进行更广泛的评估,但这些结果表明,L8-cLNPs 在以治疗相关剂量系统给药时没有毒性或免疫原性。
我们研究发现,单次给药 sgPLK1-cLNPs 可有效抑制肿瘤生长并提高原位 GBM 的存活率。我们评估了在体外观察到的高基因组编辑效果是否可以转化为体内的治疗效果。
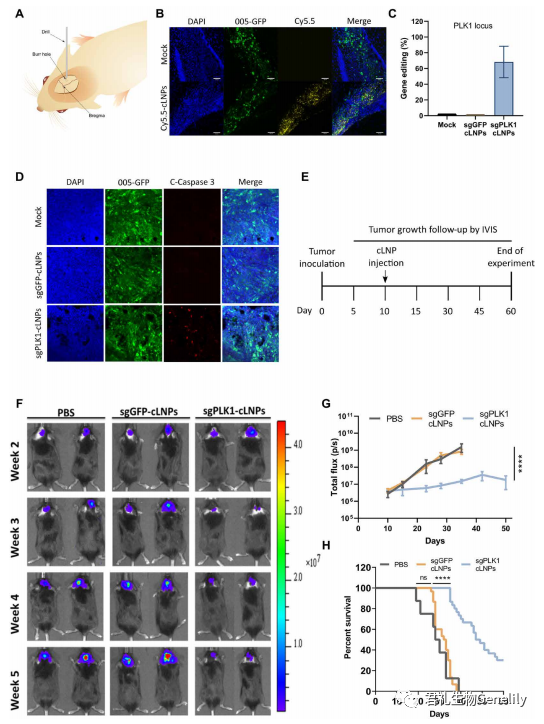
▲图 4
图 4: 将表达 GFP、mCherry 和荧光素酶的 gbm005 细胞立体定向注射到小鼠海马。10 天后,瘤内注射 cy5.5 标记的 sgGFP-cLNPs 或磷酸盐缓冲盐水 (PBS), 6 小时后处死小鼠,用荧光显微镜观察肿瘤分布。
图 4B:cy5.5 标记的 cLNPs 分布于整个肿瘤。为了评估体内基因编辑,立体定向将 sgGFP-cLNPs (0.05 mg/kg) 注射到已建立的肿瘤中,2 天后处死小鼠,并用 NGS 分析单细胞肿瘤悬液中 GFP 基因编辑。
单次脑内注射可促进肿瘤细胞中 GFP 位点 72% 的编辑 (图 S6A)。为了验证基因编辑是否会转化为 GFP 荧光的缺失,将 sgGFP-cLNPs (0.05 mg/kg) 立体定向注射到已建立的肿瘤中,7 天后处死小鼠,并用流式细胞仪分析单细胞肿瘤悬液中 GFP 的表达。肿瘤细胞中的 GFP 荧光降低了大约两倍,表明体内基因破坏 (图 S6, B 和 C)。
图 4C: 接下来,为了评估体内 PLK1 基因破坏,将 sgPLK1 或 sgGFP-cLNPs (0.05 mg/kg) 立体定向注射到已建立的肿瘤中,2 天后对小鼠实施死亡,用 NGS 对单细胞肿瘤悬液进行 PLK1 基因编辑。在肿瘤细胞中,sgPLK1-cLNPs 可促进约 68% 的 PLK1 位点编辑。探讨 PLK1 基因在体内引起的细胞凋亡将 sgPLK1 或 sgggfp - clnps (0.05 mg/kg) 立体定向注射到已建立的肿瘤中。
图 4D:3 天后处死小鼠,用荧光显微镜观察肿瘤切片中 caspase-3 的活化情况。活化的 caspase-3 只出现在 sgplk1 - clnp 处理的肿瘤中,而 sgGFP-cLNPs 处理的肿瘤中未见明显的染色,表明细胞凋亡依赖于 PLK1。邻近的正常 GFP 组织也没有显示 caspase-3 激活的迹象。由于神经元是终末分化的非分裂细胞,正常脑组织中 PLK1 的表达极少; 因此,它不可能发生凋亡。
图 4E: 接下来,我们评估了 sgPLK1-cLNPs 是否能抑制肿瘤生长。将携带 GBM 005 的小鼠定向注射一次 sgPLK1 或 sgggfp - clnps (0.05 mg/kg)。
单次瘤内注射 sgPLK1-cLNPs 可显著降低肿瘤与对照组相比,通过活动物荧光素酶活性进行量化 (图 4,F 和 G),中位存活率从 32.5 天增加到 >48 天 (图 4 H)。当实验终止时,30% 的 sgPLK1-cLNP -处理的小鼠存活了 60 天,而所有对照组小鼠在 40 天内死亡。sgGFP-cLNPs 对肿瘤生长和存活无显著影响。据我们所知,这些发现代表了这种侵袭性肿瘤在一次治疗后生存率的最高改善。
EGFR 靶向的 sgPLK1-cLNPs 可有效抑制肿瘤生长并提高转移性卵巢腺癌模型的总生存率。大多数肿瘤的治疗策略,特别是转移性或血液系统肿瘤,需要全身而不是局部给药。然而,大多数 lnp 被困在肝脏和其他中枢器官中,全身注射后不能被肿瘤细胞有效吸收。细胞靶向基因编辑策略可以增强肿瘤细胞的基因编辑,降低非转化细胞的毒性和编辑。我们最近报道了一种灵活的方法,使用系统注射 LNPs 来实现 sirna 和 mrna 的抗体靶向细胞特异性传递。
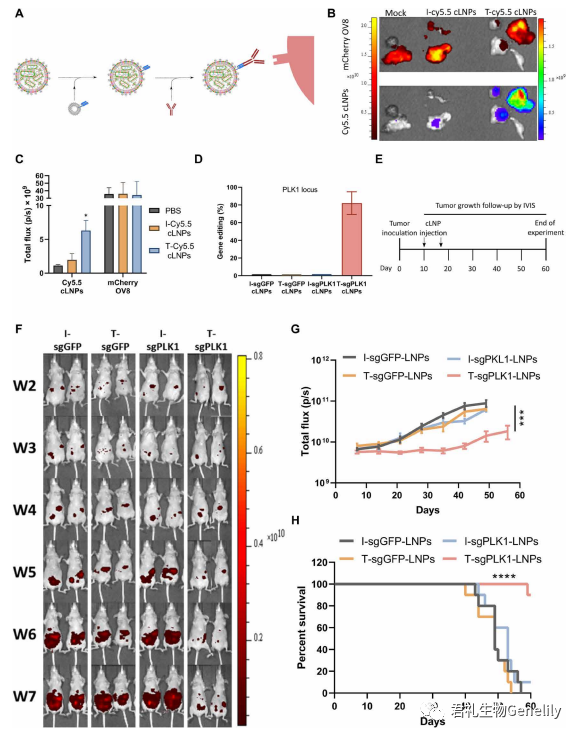
▲图 5
图 5A: 这些靶向 LNPs 通过与识别大鼠免疫球蛋白 G2a Fc 区 [IgG2A;anchor Secondary scFv Enabling Targeting (ASSET)],减少 Fc 受体对靶向抗体的识别。为了评估靶向 L8-cLNPs (T-cLNP) 对人 OV8 腹腔异种移植的体内治疗潜力,我们利用这些肿瘤高表达表皮生长因子受体 (EGFR) 的事实,通过涂敷抗 EGFR 来靶向 cLNPs 到 OV8。将携带 OV8-mCherry 弥散性腹腔肿瘤的小鼠接种肿瘤后 10 天,腹腔注射 cy5.5 标记的与抗 hegfr (T) 或 IgG 同型对照 (I) 抗体 (T -或 I - cy5.5 - clnps) 偶联的 sgGFP-cLNPs (0.75 mg/kg),以探索肿瘤靶向性和聚集性。
图 5,B 和 C:4 小时后采集肿瘤,采用活体动物荧光成像检测肿瘤中 Cy5.5 信号。在 t -Cy5.5- clnp 处理的小鼠中,肿瘤中的 Cy5.5 信号比 i -Cy5.5- clnp 处理的小鼠高 3 倍,这表明 T-cLNPs 在肿瘤中具有特异性靶向和积累。携带转移性 OV8-mCherry 肿瘤的小鼠在接种肿瘤 10 天后腹腔注射结合了抗 hegfr (T) 或 IgG 同型对照 (I) 抗体 (T-或 I- clnps) 的 sgPLK1 或 sgGFP-cLNPs (0.75 mg/kg)。
图 5D:2 天后处死小鼠,收集肿瘤,用 NGS 分析单细胞肿瘤悬液,进行 PLK1 基因编辑。在肿瘤细胞中,T-sgPLK1- cLNPs 促进了约 82% 的 PLK1 位点编辑,而在对照组中则 <1%。
图 5E: 为了评估抗肿瘤效果,在肿瘤接种 T- sgplk1 -cLNPs、I-sgPLK1- cLNPs、T- sgGFP-cLNPs 或 I-sgGFP-cLNPs (0.75 mg/kg) 后的第 10 和 17 天,将携带转移性 OV8-mCherry 肿瘤的小鼠腹腔注射。
图 5,F 和 G: 使用 mCherry 活体动物荧光成像监测肿瘤生长,仅 T-sgPLK1-cLNPs 能强烈抑制肿瘤生长。
图 5 H: 总生存率提高约 80%。
图 5 G:对照组小鼠经 T-sgGFP-cLNPs、I-sgGFP-cLNPs 或 I-sgPLK1- cLNPs 处理后,肿瘤生长或存活没有显著差异。
这些发现表明靶向 cLNPs 可能对播散性肿瘤的靶向治疗有用。
结论:
在提高 CRISPR-Cas9 基因编辑的有效性和安全性方面已经取得了显著的进展。然而,能够在体内高效编辑特定病变组织的安全传递系统将增强广泛的临床转化。由于 Cas9 核酸酶的大尺寸,它在病毒和非病毒传递系统中的封装仍然是一个挑战。
一些方法已经被用来克服将大型 Cas9 核酸酶作为核酸或蛋白运输到肝脏进行基因编辑或局部治疗遗传疾病的障碍。这些方法在肝脏中实现了约 60% 的基因编辑,导致血清中蛋白质或胆固醇水平的降低,并减轻血友病、高胆固醇血症或 TTR(转甲状腺素) 淀粉样变模型的疾病症状。
迄今为止,系统给药导致肝外组织编辑效率低,部分原因是目前的运载工具缺乏特异性靶向性。为了获得对非肝脏疾病或弥散性疾病 (如癌症) 的治疗效果,需要具有足够编辑效率的更高的组织特异性靶向。其他基因疗法,如基于 RNA 干扰 (RNAi) 的疗法,是短暂的,因此需要反复给药,特别是对快速分裂的癌细胞。基因组编辑的特性应该在一次或几次剂量后产生治疗效果,这可能严重影响毒性、不良反应的发展、依从性和成本。
此外,细菌来源的 Cas9 核酸酶使其被宿主免疫系统识别并引发免疫反应 (37,38)。长时间暴露于 Cas9 核酸酶,以及重复给药,可能会增加 Cas9 相关免疫反应的风险,随后出现免疫相关不良反应和治疗失败。因此,为了将这种风险降到最低,必须开发一种能够在有限的给药次数和较短的 Cas9 暴露时间下实现治疗相关基因组编辑的给药系统。
在本文的研究中开发并测试了一种高效的用于 CRISPR-Cas9 基因编辑的非病毒 LNP 系统,该系统在多种癌细胞类型的体外基因编辑高达 98%,在体内基因编辑高达 80%。靶向 PLK1 的 cLNPs 能够抑制肿瘤生长,并在两种侵袭性癌症小鼠模型中,在单次或双次给药后提高生存率。单剂量的 sgPLK1-cLNPs 作用于小鼠 GBM 模型的肿瘤床,可导致 PLK1 基因 70% 的基因编辑,激活的 caspase 3 染色评估可诱导体内凋亡,延长中位生存期约 50%,并提高了 005 只 GBM 小鼠 30% 的总生存期。血脑屏障 (BBB) 是一个高度限制性的障碍,大多数治疗方式。这种毁灭性疾病的临床病程十多年来没有改变,部分原因是标准化疗和免疫疗法对血脑屏障低通透性的限制。
近年来,有多个临床试验采用局部脑内给药与肿瘤切除或不切除血脑屏障; 然而,这些临床试验的成功受到所测试药物的低扩散和对健康脑实质的严重损害的阻碍。我们的研究结果突出了 cLNPs 克服当前临床相关肿瘤模型治疗局限性的潜力。
为了接触播散性肿瘤,研究中还构建了细胞靶向的 cLNPs,修饰了卵巢癌细胞上一个过表达受体的抗体。egfr 靶向的 cLNPs 在弥散性肿瘤中积累的数量明显多于 IgG 对照的 cLNPs,这表明了细胞靶向治疗弥散性肿瘤的优势。此外,单一的 egfr 靶向管理不重要的肿瘤依赖性基因,以及编辑特定的肿瘤依赖性基因 (如 BCR-ABL) 或患者和肿瘤特异性致癌基因突变 (如 RAS)。从化脓性链球菌分离的 Cas9 被用于这项概念验证研究,但可以用其他 crispr 相关核酸酶取代,以促进同源重组 (HR) 事件或减少脱靶基因编辑。将 CRISPR 技术应用于临床的另一个安全问题在于旁观者细胞的脱靶基因编辑。这种风险可以通过在 mRNA 序列中添加组织或细胞特异性的 miR 结合位点来减轻,这将导致组织特异性的 mRNA 翻译抑制。lnp 平台的主要脱靶部位是肝脏,更特异的是肝细胞和 Kupffer 细胞 (49,50),可以通过分别插入 miR122 和 miR142 结合位点来抑制这些细胞类型中的 mrna。使用这些组织特异性 mRNA 抑制方法对基因编辑技术的进一步临床发展至关重要。对于非癌症应用,我们可以设想将靶向 cLNPs 用于为患者量身定制的应用,以纠正与遗传缺陷相关的基因。另一种应用是干扰非必需基因,这种基因的敲除不会产生有害后果,但其表达会导致疾病发病。一个例子是 CCR5,它的基因敲除可能用于预防艾滋病毒传播和治愈艾滋病毒。因此,这一治疗策略为将基因组编辑作为一种治疗各种疾病的新方式开辟了新的途径,并将 CRISPR-Cas9 编辑技术带入临床。
君礼生物提供高得率和高性价比的 mRNA 和长链 RNA(多个碱基)的定制合成。在微克到毫克的级别上,开展广泛的 mRNA 修饰服务。mRNA 可从客户提供的 DNA 模板生成;或者我们可以从零开始, 提供完整的 mRNA 体外合成。我们为所有的标准 mRNA 片段进行 Cap0 和 Cap1 加帽或修饰核苷酸的处理。
有关订购和更多信息,请联系我们